Ley de Gay-Lussac
En la química podemos
ver muchas leyes de los gases, en este blog hablaremos de La Ley de
Gay-Lussac que…
- ·
Fue
enunciada por Joseph Louis Gay-Lussac a principios de 1800.
- ·
Establece
la relación entre la temperatura y la presión de un gas cuando el volumen es
constante.
Esta ley nos dice
que: La presión del gas es directamente proporcional a su temperatura
Es decir que si
aumentamos la temperatura, aumentará la presión
Y si disminuimos
la temperatura, disminuirá la presión

Luego de saber estos
puntos importantes podemos hablar de por qué ocurre esto en esta ley
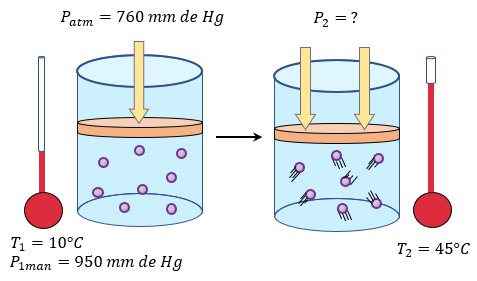
- Esto ocurre debido a que al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Formula
La ecuación o
fórmula matemática que nos explica la ley de Gay-Lussac se escribe de la
siguiente forma:
- P1/T1 = P2/T2
donde:
- P1 = Presión Inicial
- T1 = Temperatura Inicial
- P2 = Presión Final
- T2 = Temperatura Final
Esta ley, al
igual que la de Charles, está expresada en función de la temperatura absoluta.
Al igual que en la ley de Charles, las temperaturas han de expresarse en
Kelvin.
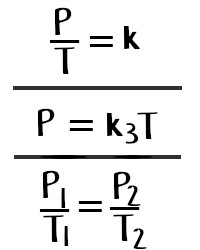
La importancia de
esta ley es básicamente que nos indica que al aumentar la temperatura de un
gas, su presión aumenta proporcionalmente, asumiendo que el volumen no cambia.
De manera muy parecida, cuando se disminuye la temperatura, la presión cae de
manera proporcional.
Comentarios
Publicar un comentario